สมดุลเคมี
สมดุลเคมี
(Chemical Equilibrium)
= สภาวะที่ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ไม่เปลี่ยนแปลงอีกแม้เวลาผ่านไป มีอัตราการเปลี่ยนแปลงไปข้างหน้าเท่ากับอัตราการเปลี่ยนแปลงผันกลับ
การเปลี่ยนแปลงที่ผันกลับได้
การเกิดปฏิกิริยาแบ่งออกเป็น 2 ประเภท ได้แก่
1. ปฏิกิริยาที่เกิดสมบูรณ์
ปฏิกิริยาที่สารตั้งต้นทำปฏิกิริยากันจนหมด เป็นปฏิกิริยาที่ไม่ย้อนกลับ
2. ปฏิกิริยาที่เกิดไม่สมบูรณ์
ปฏิกิริยาที่สารตั้งต้นทำปฏิกิริยากันได้ผลิตภัณฑ์ และผลิตภัณฑ์ที่เกิดขึ้นทำปฏิกิริยา
กลับเป็นสารตั้งต้นใหม่ เป็นปฏิกิริยาที่ผันกลับได้
ปฏิกิริยาที่ผันกลับได้
ปฏิกิริยาที่เกิดสารผลิตภัณฑ์ แล้วสารผลิตภัณฑ์มีการเปลี่ยนแปลงกลับมาเป็นสารตั้งต้นได้อีก
มี 2 ปฏิกิริยาย่อย คือ
- ปฏิกิริยาไปข้างหน้า คือ ปฏิกิริยาที่สารตั้งต้นเปลี่ยนเป็นผลิตภัณฑ์
- ปฏิกิริยาย้อนกลับ คือ ปฏิกิริยาที่สารผลิตภัณฑ์เปลี่ยนกลับเป็นสารตั้งต้น
ปฏิกิริยาที่ผันกลับได้เขียนแทนด้วย ⇋
A ⇋ B
การเปลี่ยนแปลงที่ก่อให้เกิดสมดุลเคมี แบ่งเป็น 3 ประเภท
1. การเปลี่ยนสถานะ เช่น การกลายเป็นไอของน้ำในภาชนะปิด
H2O(l) ⇌ H2O(g)
2. การเกิดสารละลาย เช่น การละลายของเกลือ NaCl ในน้ำ ได้สารละลาย เมื่อให้ความร้อนจะเกิดเป็นสารละลายอิ่มตัว เมื่ออุณหภูมิลดลงจะเกิดการตกผลึกของเกลือ NaCl กลับมา
NaCl (s) + H2O ⇌ Na+(aq) + Cl- (aq)
3. การเกิดปฏิกิริยาเคมี การเกิดปฏิกิริยาบางปฏิกิริยาสามารถผันกลับได้และเกิดสมดุลเคมี
-----------------------------------------------------------------------------------------------------
การเปลี่ยนแปลงที่ทำให้เกิดภาวะสมดุล
ภาวะสมดุล
เกิดเมื่ออัตราการเกิดปฏิกิริยาไปข้างหน้า = อัตราการเกิดปฏิกิริยาย้อนกลับ ที่สมดุลจะมีสารตั้งต้นทุกชนิดเหลืออยู่ และผลิตภัณฑ์ที่เกิดขึ้นทุกชนิดคงที่ ถ้าในระบบยังคงมีการเกิดปฏิกิริยาไปข้างหน้า และปฏิกิริยาย้อนกลับอยู่ตลอดเวลา โดยเกิดในอัตราที่เท่ากัน เรียกว่า สมดุลไดนามิก
คุณสมบัติของสมดุลเคมี :
- เกิดในระบบปิด
- เป็นการเปลี่ยนแปลงที่ผันกลับได้
- อัตราการเกิดปฏิกิริยาไปข้างหน้า = อัตราการเกิดปฏิกิริยาย้อนกลับ
- ในระบบต้องมีสารตั้งต้นและผลิตภัณฑ์เหลืออยู่
- สมบัติของระบบคงที่
กราฟแสดงการเกิดภาวะสมดุล
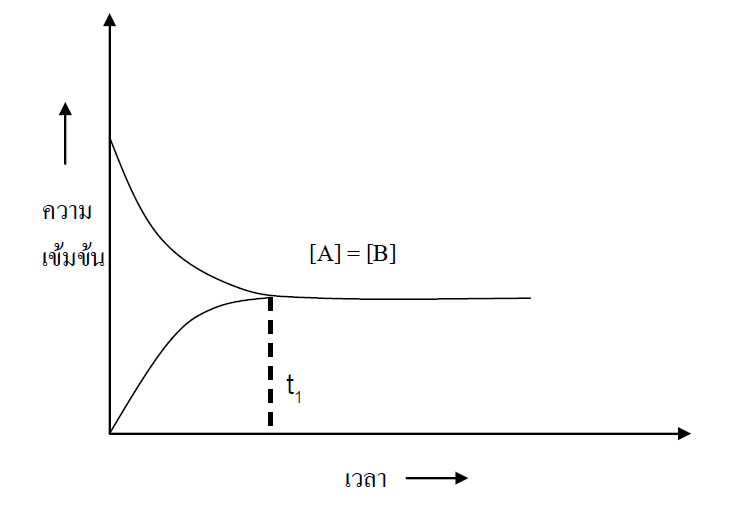
1. กราฟระหว่างความเข้มข้นกับเวลา
[สารตั้งต้น] ﹥ [ผลิตภัณฑ์]
❸ ภาวะสมดุลที่เวลา t1 ความเข้มข้นของสาร A เท่ากับความเข้มข้นของสาร B
[สารตั้งต้น] = [ผลิตภัณฑ์]
2. กราฟระหว่างอัตราการเกิดปฏิกิริยากับเวลา
เมื่อ X2 ทำปฏิกิริยากับ Y2 จะเกิดปฏิกิริยาไปข้างหน้าได้ผลิตภัณฑ์เป็น XY2 ซึ่งเมื่อเขียนกราฟอัตราการเกิดปฏิกิริยาของปฏิกิริยาไปข้างหน้าและปฏิกิริยาย้อนกลับ จะพบว่ากราฟทั้งสองเส้นจะมาทับกันที่เวลา t2 แสดงว่า อัตราการเกิดปฏิกิริยาไปข้างหน้า = อัตราการเกิดปฏิกิริยาย้อนกลับ
-----------------------------------------------------------------------------------------------------
ความสัมพันธ์ระหว่างความเข้มข้นของสารต่างๆ ณ ภาวะสมดุล
ค่าคงที่ของสมดุล
คือ ผลคูณความเข้มข้นของสารผลิตภัณฑ์ ยกกำลังด้วย เลขบอกจำนวนโมลสารผลิตภัณฑ์ หารด้วย ผลคูณความเข้มข้นของสารตั้งต้น ยกกำลังด้วย เลขบอกจำนวนโมลสารตั้งต้น มีสัญลักษณ์เป็น K
ถ้าปฏิกิริยาคือ aA + bB ⇌ cC + d จะได้ค่าคงที่สมดุล ดังนี้
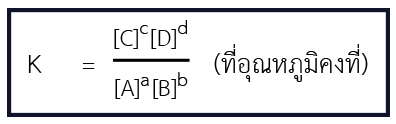
** ถ้าในปฏิกิริยามีสารที่เป็น ของแข็งหรือของเหลวบริสุทธิ์ ไม่ต้องนำความเข้มข้นของสารนั้นมาคำนวณในการหาค่า K **
ตัวอย่าง CaCO3(s) ⇋ CaO(s) + CO2 (g)
จะได้ค่าคงที่สมดุลคือ K = [CO2]
ค่าคงที่สมดุลกับสมการเคมี
1. ถ้านำสมการเคมีมาเขียนกลับกันกับสมการเดิม ค่า K ก็จะเป็นส่วนกลับของค่าเดิม
2. เมื่อนำเลขมาคูณในสมการ ค่า K ใหม่จะเท่ากับค่า K เดิมยกกำลังด้วยเลขนั้น
3. ค่า K ที่เกิดจากการนำปฏิกิริยาย่อยมารวมกัน จะมีค่าเท่ากับผลคูณของค่า K ของปฏิกิริยาย่อยเหล่านั้น
4. ถ้ามีการนำเลขมาหารในสมการ ค่า K ใหม่จะเท่ากับค่า K เดิมถอดรากที่เท่ากับตัวเลขที่นำมาหารนั้น
การหาค่าคงที่สมดุล
- เขียนสมการเคมีและดุลสมการเคมี
- หาความเข้มข้นของสารผลิตภัณฑ์และสารตั้งต้นที่ภาวะสมดุล
- เขียนค่า K จากสมการที่ได้ และแทนค่าความเข้มข้นของสารที่หาได้ลงในสมการ
ตัวอย่าง
แก๊สไนโตรซิลคลอไรด์ (NOCl) 2.5 mol ในภาชนะ 1.5 L สลายตัวที่ 400 ºC ได้ดังสมการ
2NOCl ⇋ 2NO + Cl₂
หลังจากเข้าสู่ภาวะสมดุล พบว่าแก๊สไนโตรซิลคลอไรด์สลายตัว 28% จงหาค่าคงที่สมดุลของปฏิกิริยานี้
-----------------------------------------------------------------------------------------------------
การเปลี่ยนแปลงความเข้มข้น
การเพิ่มหรือลดความเข้มข้น จะทำให้ระบบเสียภาวะสมดุล ระบบจะต้องมีการปรับตัวให้กลับสู่สภาวะสมดุลใหม่เสมอ การเปลี่ยนแปลงความเข้มข้นมีผลต่อภาวะสมดุลของระบบ แต่ไม่มีผลต่อค่าคงที่สมดุล
- ถ้าเพิ่มความเข้มข้น ระบบจะปรับตัวโดยลดความเข้มข้นสารที่เติมลงไป (สมดุลเลื่อนไปฝั่งตรงข้ามที่เติมสาร)
- ถ้าลดความเข้มข้น ระบบจะปรับตัวโดยเพิ่มความเข้มข้นของสารนั้น (สมดุลเลื่อนไปฝั่งที่ลดสาร)
ตัวอย่าง
CH₄ (g) + 2H₂S(g) ⇋ CS₂(g) + 4H₂(g)
เพิ่มความเข้มข้น CH₄ : สมดุลเลื่อนไปทางขวา [CH2]↑ , [H2S]↓ , [CS2]↑ , [H2]↑
ลดความเข้มข้น CH₄ : สมดุลเลื่อนไปทางซ้าย [CH2]↓ , [H2S]↑ , [CS2]↓ , [H2]↓
เพิ่มความเข้มข้น CS₂ : สมดุลเลื่อนไปทางซ้าย [CH2]↑ , [H2S]↑ , [CS2]↑ , [H2]↓
เพิ่มความเข้มข้น CS₂ : สมดุลเลื่อนไปทางขวา [CH2]↓ , [H2S]↓ , [CS2]↓ , [H2]↑
การเปลี่ยนแปลงความดัน
มีผลในระบบที่มีก๊าซเป็นองค์ประกอบ ไม่มีผลต่อค่าคงที่สมดุล การเปลี่ยนแปลงความดันมีผลต่อภาวะสมดุลของระบบ ดังนี้
- เพิ่มความดัน สมดุลจะเลื่อนไปในทางที่มีโมลรวมแก๊สน้อย
- ลดความดัน สมดุลจะเลื่อนไปทางที่มีโมลรวมแก๊สมาก
**ถ้าโมลรวมแก๊สเท่ากันทั้งสองฝั่ง ความดันไม่มีผล**
ตัวอย่าง
NO(g) + NO2(g) ⇋ N2O3(g)
เพิ่มความดัน (ลด V ) : สมดุลเลื่อนไปทางขวา
ลดความดัน (เพิ่ม V) : สมดุลเลื่อนไปทางซ้าย
การเปลี่ยนแปลงอุณหภูมิ
เมื่อมีการเปลี่ยนแปลงอุณหภูมิในระบบ ส่งผลให้ระบบปรับตัวเข้าสู่สมดุลใหม่ และทำให้ค่าคงที่สมดุลเปลี่ยนไปด้วย
ปฏิกิริยาคายความร้อน
A ⇋ B + 2.5 KJ หรือ A ⇋ B ΔH = -2.5 KJ
- เพิ่มอุณหภูมิ สารตั้งต้นเพิ่มขึ้น ผลิตภัณฑ์ลดลง ค่า K ลดลง
- ลดอุณหภูมิ สารตั้งต้นลดลง ผลิตภัณฑ์เพิ่มขึ้น ค่า K เพิ่มขึ้น
ปฏิกิริยาดูดความร้อน
A + 2.5 KJ ⇋ B หรือ A ⇋ B ΔH = +2.5 KJ
- เพิ่มอุณหภูมิ สารตั้งต้นลดลง ผลิตภัณฑ์เพิ่มขึ้น ค่า K เพิ่มขึ้น
- ลดอุณหภูมิ สารตั้งต้นเพิ่มขึ้น ผลิตภัณฑ์ลดลง ค่า K ลดลง









ความคิดเห็น
แสดงความคิดเห็น